维生素是维持人体健康不可或缺的微量营养素,但有一类物质虽未被正式归类为维生素,却展现出类似的生物活性与代谢调节功能,被称为“类维生素”。它们在细胞分化、免疫调节、抗氧化等过程中发挥着关键作用,其代谢异常与多种疾病密切相关。近年来,随着分子生物学研究的深入,科学家揭示了这些物质在疾病预防与治疗中的新潜力。
一、类维生素的代谢网络与核心功能
类维生素涵盖视黄酸衍生物(如维生素A代谢产物)、辅酶Q10、α-硫辛酸等物质,其代谢路径与细胞信号传导紧密交织。以维生素A代谢为例,食物中的视黄醇经肠道吸收后,在肝脏储存为视黄酯,靶细胞则通过醛脱氢酶(如ALDH1a2)将其转化为视黄酸(RA)。RA进一步通过CYP26家族酶氧化为4-氧代-RA等活性分子,调控300多个基因表达。值得注意的是,4-氧代-RA不仅是造血干细胞休眠的关键调节因子,其与RARβ受体的结合异常还与白血病发生相关。
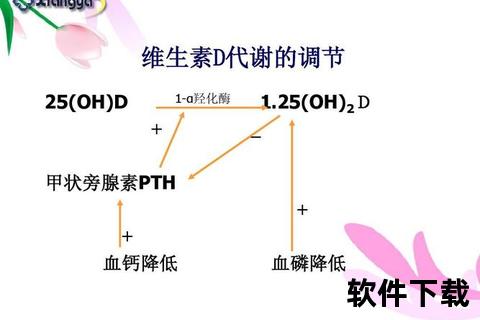
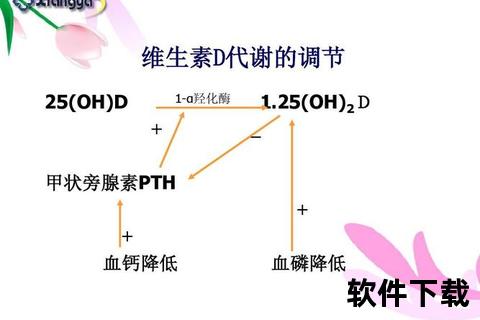
维生素D的代谢更具复杂性:皮肤合成的D3或食物摄入的D2需经肝脏羟化为25(OH)D,再通过肾脏CYP27B1转化为活性形式1,25(OH)2D。这种代谢物不仅能调节钙磷平衡,还可通过抑制IL-6、IL-17等炎性因子,改善胰岛素抵抗。临床数据显示,2型糖尿病患者血清25(OH)D水平普遍低于健康人群,补充维生素D可使糖化血红蛋白降低0.3%-0.5%。
二、代谢失衡的预警信号与人群差异
类维生素缺乏的早期症状常具有隐匿性:
特殊人群需特别注意代谢风险:
1. 肠道疾病患者:克罗恩病等炎症性肠病会破坏视黄酸合成酶ALDH1a2的活性,导致局部RA浓度下降,加剧肠黏膜修复障碍
2. 老年人:皮肤合成维生素D能力下降70%-80%,同时肾脏羟化酶活性降低,双重因素加剧缺乏风险
3. 代谢综合征人群:肥胖引起的慢性炎症会加速维生素E的消耗,其苯并二氢吡喃环结构通过清除自由基保护细胞膜,但侧链的ω氧化过程易受高脂饮食干扰
三、干预策略:从精准补充到代谢调控
基于最新研究证据,类维生素的干预需遵循三级策略:
1. 基础营养强化
2. 靶向补充方案
3. 代谢通路调节
四、特殊场景下的应急处理
当出现严重代谢紊乱症状时,需采取分级应对:
值得关注的是,类维生素的代谢研究正在推动精准医学发展。例如,维生素B12被发现是细胞重编程的关键限速因子,补充后可使结肠炎模型小鼠的肠上皮修复速度提高2倍。而维生素C通过DKG代谢物调控组蛋白修饰,为再生医学提供了新靶点。
行动建议
1. 40岁以上人群每年检测血清25(OH)D、视黄醇结合蛋白等指标
2. 慢性病患者选择复合补充剂时,需注意成分相互作用(如维生素E与他汀类药物)
3. 出现持续疲劳、反复感染等非特异性症状时,优先排查类维生素代谢状态
