帕金森病(Parkinson’s Disease, PD)是一种以运动迟缓、静止性震颤和肌肉强直为主要特征的神经退行性疾病。随着病程进展,患者可能面临运动并发症、认知功能下降等问题。本文结合最新研究和临床指南,系统解析帕金森病的药物治疗机制及用药方案,帮助患者和家属科学管理疾病。

一、帕金森病的药物治疗机制
帕金森病的核心病理是大脑黑质多巴胺能神经元退化,导致多巴胺分泌不足。药物通过以下机制发挥作用:
1. 补充多巴胺
2. 激活多巴胺受体
3. 抑制多巴胺降解
4. 其他辅助药物
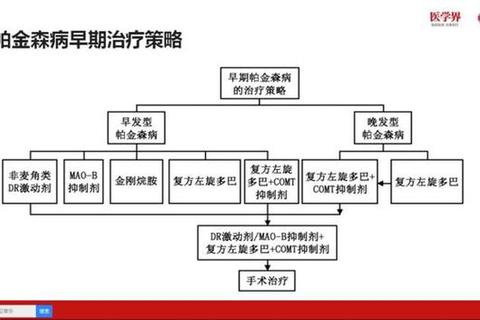
二、个体化用药方案
1. 早期帕金森病的药物选择
案例示范:
一名60岁早发型患者,无认知障碍,可首选普拉克索(起始剂量0.125mg,每日3次),若疗效不足,再联用小剂量左旋多巴(125-250mg/d)。
2. 中晚期患者的调整策略
3. 特殊人群用药注意
三、前沿进展与未来方向
1. 疾病修饰疗法
研究显示,MAO-BI(如雷沙吉兰)和部分DAs可能延缓神经元退化,但仍需更多证据支持。
2. 靶向α-突触白
复旦大学团队发现神经元受体FAM171A2是病理性α-突触白内吞的关键介质,并筛选出小分子抑制剂Bemcentinib,为早期干预提供新方向。
3. 新型给药方式
左旋多巴肠凝胶(Duopa)通过持续输注稳定血药浓度,减少疗效波动,适用于晚期患者。
四、患者日常管理建议
1. 用药依从性:定时定量服药,避免突然停药(可能诱发恶性综合征)。
2. 饮食配合:高蛋白饮食可能影响左旋多巴吸收,建议餐前1小时或餐后2小时服药。
3. 运动康复:步态训练、平衡练习可改善冻结步态,结合视觉提示(如激光束)效果更佳。
4. 就医指征:若出现严重“关期”症状(如无法起身)、精神异常或药物副作用(如心律失常),需立即就诊。
帕金森病的药物治疗需兼顾症状控制与长期管理,通过个体化方案和跨学科协作(如神经科、康复科)优化疗效。未来随着靶向治疗和人工智能辅助药物筛选的发展,患者有望获得更精准的治疗选择。
