结肠炎作为一类常见的肠道炎症性疾病,其反复发作的腹泻、腹痛、黏液脓血便等症状严重影响患者的生活质量。随着医学研究的深入,药物治疗方案日益精细化,但许多患者仍面临“用药选择困难”“疗效不明确”“副作用担忧”等问题。本文将从病理机制、药物分类、疗效评估及特殊人群管理四方面展开解析,帮助患者和公众科学理解治疗方案。
一、结肠炎的病理分型与药物选择逻辑
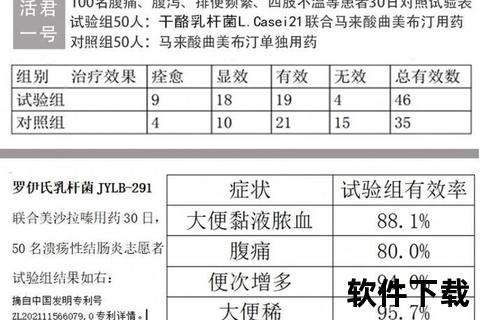
结肠炎并非单一疾病,而是涵盖感染性、溃疡性、缺血性等多种类型的炎症总称。其中,溃疡性结肠炎(UC)和克罗恩病(CD)作为炎症性肠病(IBD)的主要类型,需长期甚至终身治疗。
1. 感染性结肠炎:多由细菌、病毒或寄生虫引发,抗生素(如甲硝唑)联合肠道微生态调节剂(如双歧杆菌)是核心方案。
2. 溃疡性结肠炎:自身免疫异常导致结肠黏膜持续炎症,需阶梯式用药:轻中度患者首选5-氨基水杨酸(5-ASA),中重度则需激素、免疫抑制剂或生物制剂。
3. 克罗恩病:病变可累及全消化道,生物制剂(如英夫利昔单抗)联合免疫抑制剂(如硫唑嘌呤)是主流方案。
关键逻辑:药物选择需基于疾病类型、活动度、病变范围及患者个体特征,如年龄、并发症、既往治疗反应等。
二、核心药物分类与作用机制
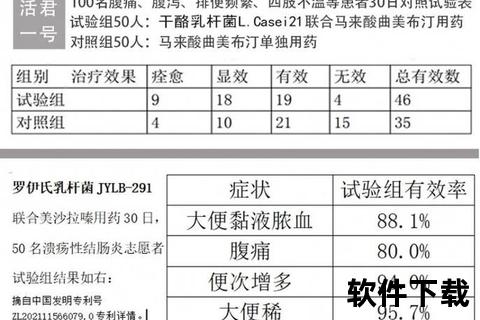
1. 传统药物:基础治疗的主力军
5-氨基水杨酸(5-ASA):如美沙拉嗪,通过抑制前列腺素合成减轻炎症,适用于轻中度UC的诱导和维持治疗。直肠局部用药(栓剂/灌肠)对远端结肠炎效果显著。
糖皮质激素:如泼尼松,快速控制急性期炎症,但长期使用可能导致骨质疏松、感染风险增加,需在3-6个月内逐渐减停。
免疫抑制剂:硫唑嘌呤、环孢素等用于激素依赖或无效患者,通过调节免疫反应维持缓解,需监测肝肾功能和血常规。
2. 生物制剂:精准靶向治疗的新突破
抗TNF-α单抗(如英夫利昔单抗):阻断促炎因子TNF-α,适用于中重度UC和CD,可促进黏膜愈合并减少手术需求。
IL-12/23抑制剂(如乌司奴单抗):针对Th17细胞通路,对传统治疗无效的CD患者有效。
IL-23抑制剂(如Guselkumab):最新III期临床试验(QUASAR研究)显示,其对中重度UC的临床缓解率和内镜改善率显著优于安慰剂,且安全性良好。
3. 辅助治疗药物
微生态制剂:双歧杆菌、酪酸梭菌等调节肠道菌群平衡,减轻炎症反应。
中药制剂:如痛泻宁颗粒、参倍固肠胶囊,中西医结合可减少复发,但需在专业医师指导下使用。
三、疗效评估:从症状缓解到黏膜愈合
结肠炎的治疗目标已从“控制症状”升级为“深度缓解”,即临床缓解、内镜愈合与组织学修复三重达标。
1. 临床评估指标:
症状评分:腹泻频率、腹痛程度、便血情况等。
生活质量量表(如IBDQ):评估日常活动、情绪状态等。
2. 客观检查:
内镜检查:黏膜糜烂、溃疡愈合情况是金标准。
粪便钙卫蛋白:非侵入性指标,反映肠道炎症活动度。
3. 治疗应答不足的应对策略:
调整药物剂量(如英夫利昔单抗从5mg/kg增至10mg/kg)。
转换治疗靶点(如从抗TNF-α转为IL-23抑制剂)。
四、特殊人群用药注意事项
1. 儿童患者:
首选5-ASA(如美沙拉嗪颗粒剂),避免长期使用激素。
生物制剂需权衡生长发育影响,推荐早期干预以减少肠道损伤。
2. 孕妇与哺乳期女性:
妊娠期首选局部用药(如美沙拉嗪栓),避免使用甲氨蝶呤等致畸药物。
哺乳期可使用益生菌,禁用补脾益肠丸等含不明成分的中成药。
3. 老年患者:
慎用免疫抑制剂(感染风险高),优先选择微生态制剂联合低剂量5-ASA。
五、患者行动建议:居家管理与就医时机
1. 日常管理:
饮食调整:低渣、低脂、高蛋白饮食,避免辛辣、乳制品及酒精。
症状记录:记录排便次数、性状及伴随症状,复诊时提供详细数据。
2. 紧急就医信号:
突发剧烈腹痛、高热、便血量增加(警惕肠穿孔或中毒性巨结肠)。
药物治疗后症状持续加重或出现过敏反应(如皮疹、呼吸困难)。
3. 长期随访:
每3-6个月复查肠镜及血液指标,评估黏膜愈合与药物安全性。
结肠炎的药物治疗已进入“个体化精准时代”,患者需与医生共同制定长期管理计划,平衡疗效与安全性。未来,随着IL-23抑制剂等新药的应用,以及肠道菌群移植等技术的成熟,更多患者将实现高质量缓解。
注:本文内容参考最新临床研究及指南,具体用药请遵医嘱。
相关文章:
文章已关闭评论!


