胶质脑瘤是中枢神经系统最常见的原发性肿瘤之一,其治疗与预后一直是患者及家属关注的焦点。本文将从病理分级、治疗手段及生存期影响因素等角度,结合最新临床数据,为公众提供科学、实用的解析与建议。
一、胶质脑瘤的分级与生存率
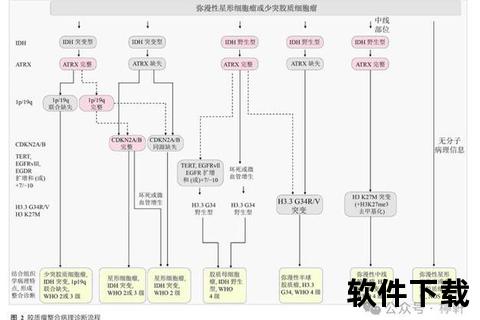
根据世界卫生组织(WHO)分类,胶质瘤分为1-4级,级别越高,恶性程度和侵袭性越强,生存率越低。
1. 1级胶质瘤(低级别)
典型类型:毛细胞星形细胞瘤,多见于儿童和青少年。
生存期:手术全切后,患者可实现长期生存甚至治愈,10年以上生存率高达87.25%。若未完全切除,需结合放疗或化疗,但仍可能复发。
2. 2级胶质瘤(低级别)
典型类型:弥漫性星形细胞瘤、少突胶质细胞瘤。
生存期:经手术、放疗和化疗综合治疗后,中位生存期可达5-10年,部分患者可存活15年以上。少突胶质细胞瘤若存在IDH突变和1p/19q共缺失,预后更佳。
3. 3级胶质瘤(高级别)
典型类型:间变性星形细胞瘤、间变性少突胶质细胞瘤。
生存期:无IDH突变的患者平均生存期为2-3年,存在突变者可延长至3-5年;若合并1p/19q共缺失,生存期可达4-9年。
4. 4级胶质瘤(高级别)
典型类型:胶质母细胞瘤(GBM),恶性程度最高。
生存期:未经治疗者生存期仅3个月;经手术、放疗和替莫唑胺化疗后,中位生存期约15个月,5年存活率不足10%。近年靶向治疗和免疫疗法的应用,使部分患者生存期延长至3年以上。
二、影响胶质脑瘤生存期的核心因素
1. 病理分级与分子特征
胶质瘤的级别直接决定恶性程度,而分子标志物(如IDH突变、1p/19q共缺失)进一步细化预后分层。例如,IDH突变型胶质瘤对放化疗更敏感,生存期显著优于野生型。
2. 手术切除程度
全切(GTR):肿瘤完全切除可显著延长生存期。例如,高级别胶质瘤全切后中位生存期比次全切(STR)延长3-4倍。
次全切(STR):适用于功能区或深部肿瘤,需结合术后辅助治疗以控制残留病灶。
3. 年龄与身体状态
年轻患者(<40岁)因免疫系统较强且耐受性更好,生存率显著高于老年患者。例如,儿童低级别胶质瘤的5年生存率可达70-80%。
4. 肿瘤位置与大小
易切除区域:额叶、颞叶等表浅部位肿瘤手术风险低,预后较好。
高危区域:脑干、丘脑等深部肿瘤手术难度大,易导致神经功能损伤,生存率较低。
5. 治疗手段的综合应用
术后放疗可降低复发率,化疗(如替莫唑胺)可穿透血脑屏障,抑制肿瘤进展。新疗法如电场治疗(TTFields)和免疫检查点抑制剂,为晚期患者提供新希望。
三、治疗策略与最新进展
1. 手术:生存率的第一道防线
术前规划:利用术中MRI、神经导航等技术,精准定位肿瘤边界,减少功能损伤。
术后评估:术后48小时内需进行MRI复查,确认切除范围。
2. 放疗与化疗的协同作用
放疗:标准剂量为60 Gy,分30次完成,可延长高级别胶质瘤生存期。
化疗:替莫唑胺联合放疗的中位生存期比单纯放疗提高近6个月。
3. 分子靶向与免疫治疗
靶向药物:针对BRAF V600E突变(达拉非尼)或NTRK融合(拉罗替尼)的疗法已进入临床。
免疫治疗:PD-1抑制剂在部分复发胶质母细胞瘤中显示出应答,但仍需更多研究验证。
四、患者行动建议:从就医到日常护理
1. 何时就医?
预警症状:持续头痛、恶心呕吐、癫痫发作、肢体无力或性格改变需立即就诊。
儿童特殊表现:发育迟缓、步态不稳或频繁跌倒可能是脑干胶质瘤的早期信号。
2. 治疗中的注意事项
术后护理:避免剧烈运动,监测意识状态和肢体活动。
放疗/化疗副作用管理:脱发和疲劳常见,可补充高蛋白饮食(如鸡蛋、牛奶)并适度运动。
3. 长期生存的支持策略
心理支持:焦虑和抑郁常见,建议加入患者互助小组或寻求心理咨询。
定期复查:术后每3-6个月进行MRI检查,监测复发。
五、特殊人群的差异化管理
1. 儿童患者
儿童胶质瘤以低级别为主,手术全切后预后较好,但需注意放疗对生长发育的影响,建议采用质子治疗以减少副作用。
2. 老年患者
手术风险较高,需综合评估身体状态,优先选择创伤小的活检或姑息治疗。
3. 孕妇
妊娠期胶质瘤进展可能加速,需多学科会诊权衡胎儿安全与母体治疗时机。
胶质脑瘤的生存率虽受多重因素影响,但早期诊断、规范治疗和科学护理可显著改善预后。患者需与医疗团队紧密配合,结合个体化方案争取最佳疗效。随着分子医学和精准治疗的进步,胶质瘤的“长期生存”已非遥不可及的目标。
相关文章:
文章已关闭评论!

